Diagnóstico por laboratorio
Para identificar la infección por Cryptococcus el médico debe indagar sobre signos y síntomas y
los
factores de riesgo del paciente. Según los órganos posiblemente comprometidos se deberán enviar
todas las muestras posibles para descartar si hay diseminación del agente. Las muestras clínicas más
comúnmente remitidas al laboratorio para el diagnóstico de criptococosis incluyen: líquido
cefalorraquídeo, sangre, esputo, lavado broncoalveolar, orina, material purulento, biopsias u otros
líquidos, y la escarificación de las lesiones cuando las lesiones son en piel o mucosas. Estas
muestras serán procesadas de acuerdo a su tipo para la realización de exámenes directos,
coloraciones histopatológicas, cultivos y pruebas adicionales. También es posible la obtención de
LCR o suero para la realización de técnicas de inmunodiagnóstico.
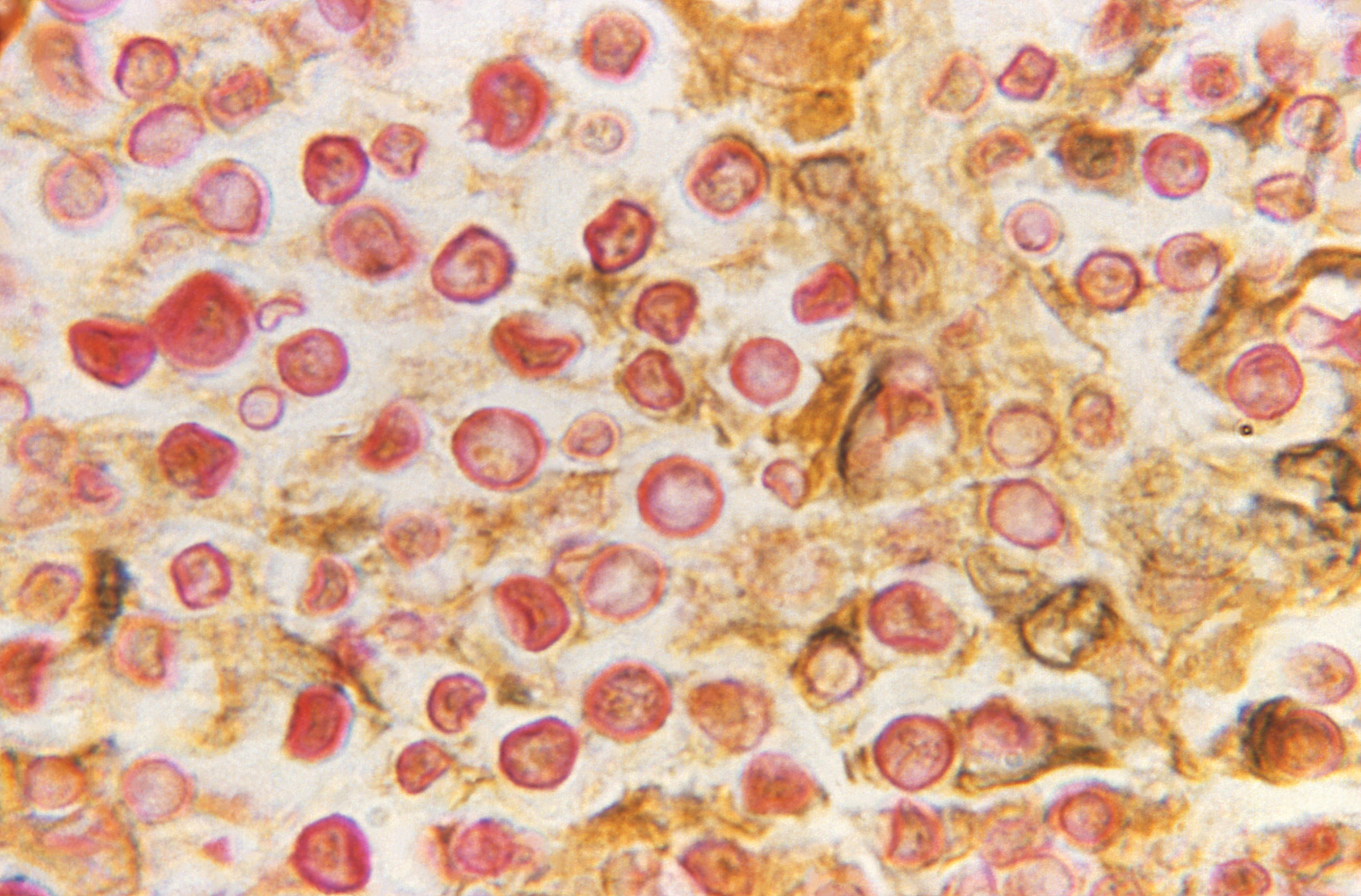
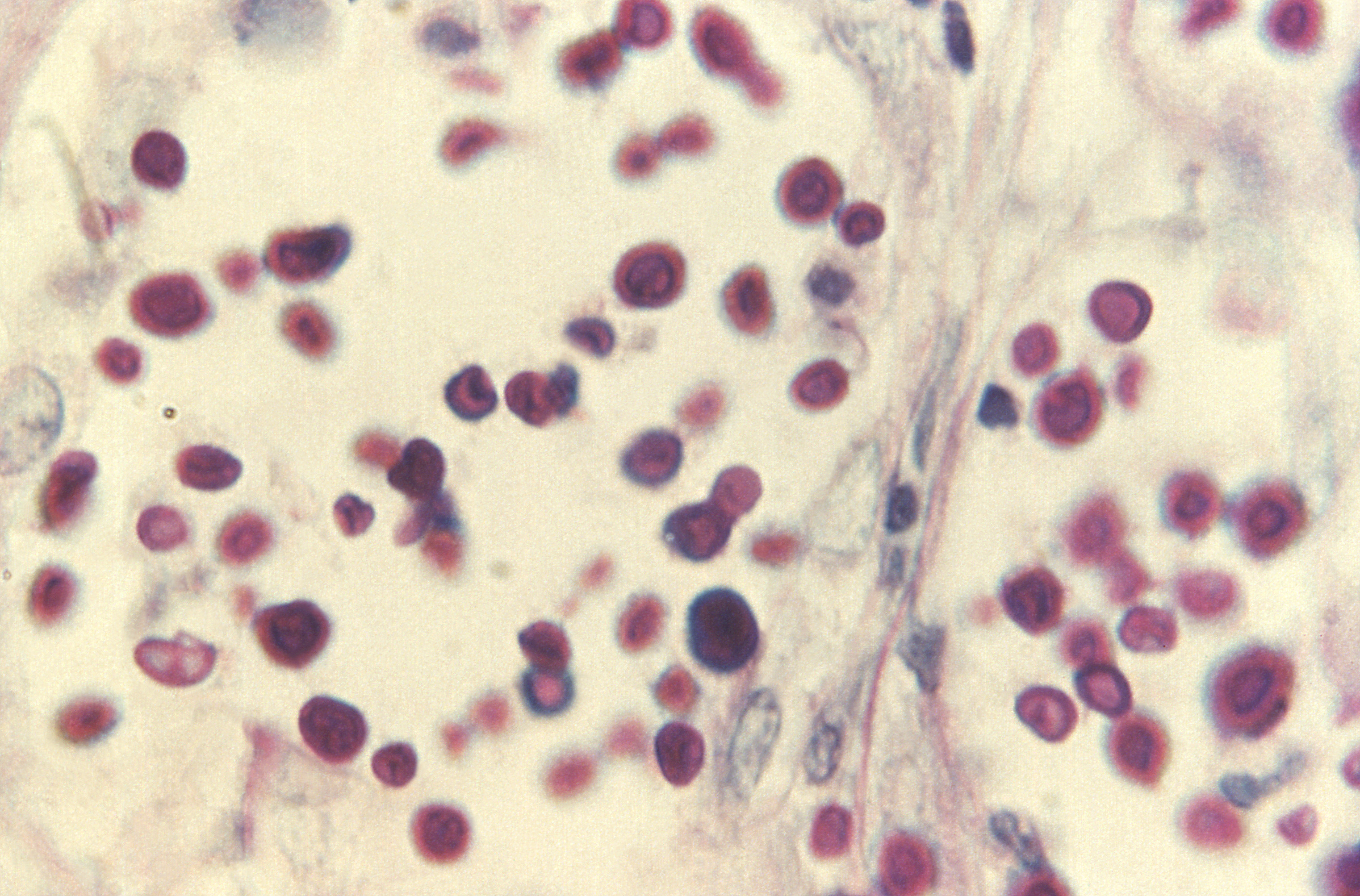
Examen directo e histopatología (microscopía)
Los exámenes directos ofrecen resultados
rápidos para que el médico pueda tomar decisiones más acertadas al
momento de iniciar la terapia antimicótica. A partir de las muestras
líquidas se puede realizar el examen directo en fresco entre lámina
y laminilla y en todas las muestras, el KOH, ambos para ser
observados en los objetivos de 10X y 40X. La morfología de las
blastoconidias no es exclusiva para Cryptococcus y en estos
montajes directos no es posible observar la capsula, por tanto, no
se podría especificar el género del hongo. Para evidenciar la
presencia de cápsula y poder informar al médico que las
blastoconidias corresponden a Cryptococcus spp. deben
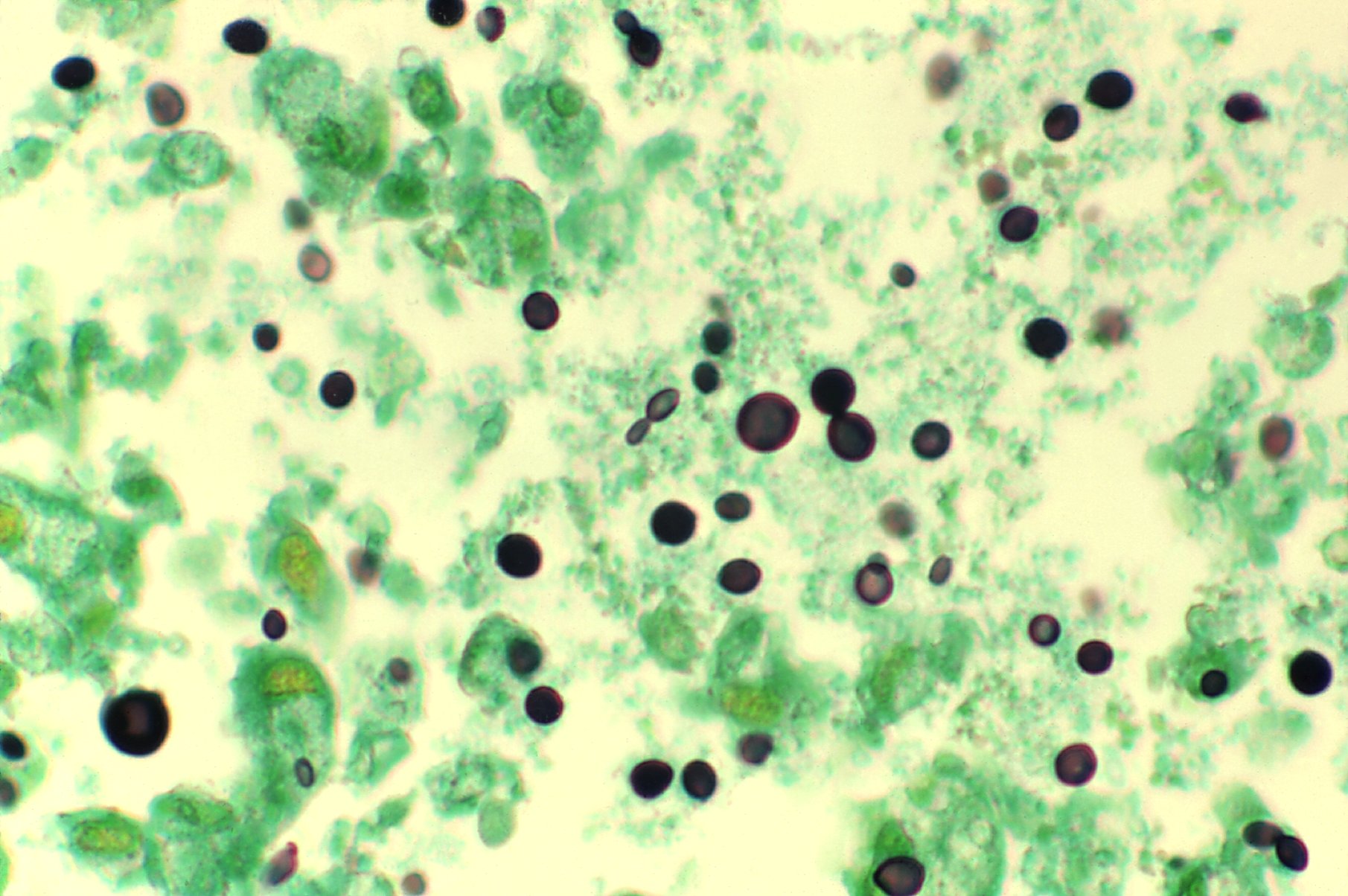
realizarse los directos con tinta china, nigrosina o azul de
metileno (este colorante se utiliza para muestras como material
purulento o leche donde la tinta china y la nigrosina se flocula).
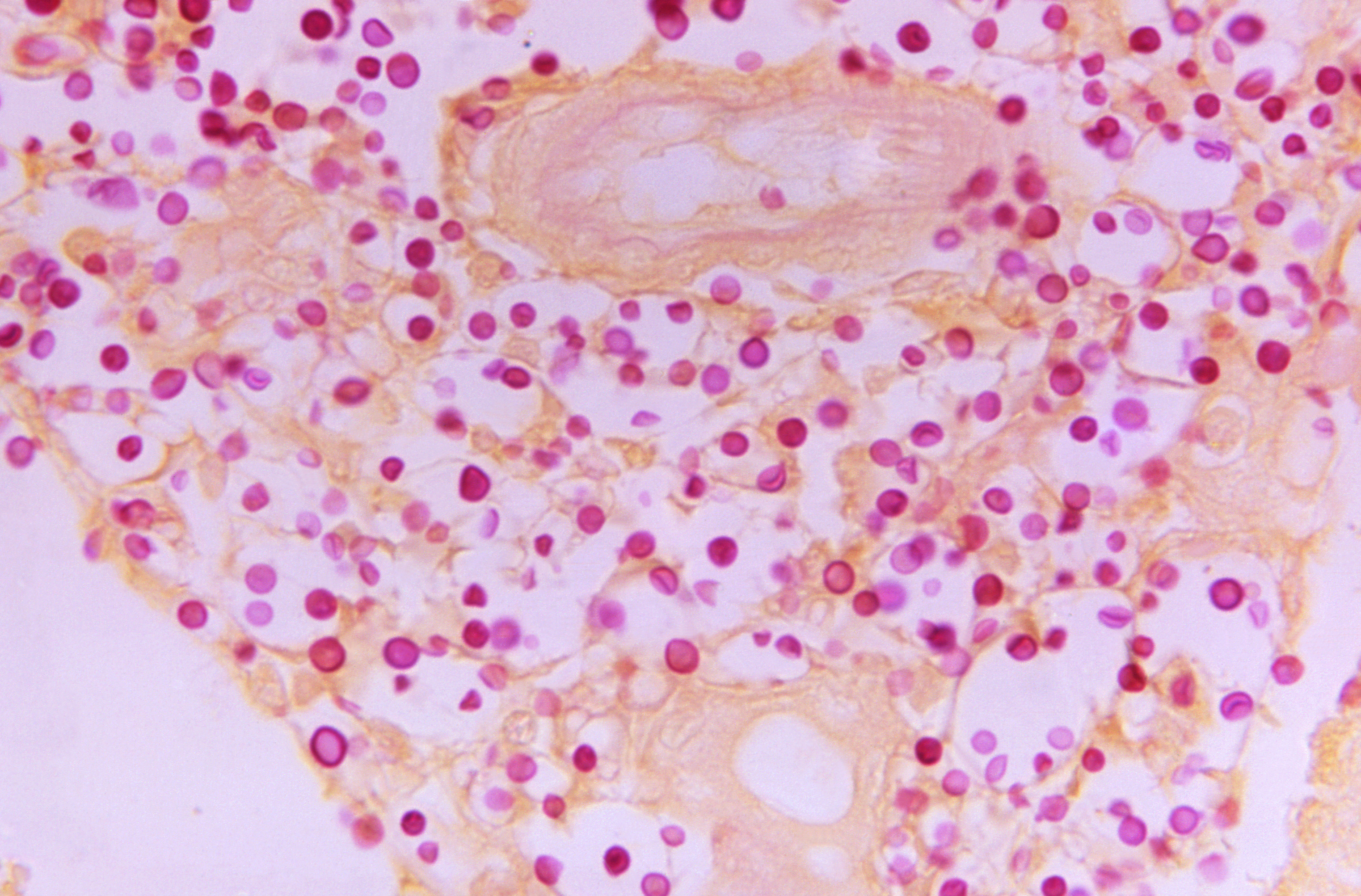
En la coloración de Gram también es posible la observación de las
blastoconidias, además es posible que la cápsula se insinúe.
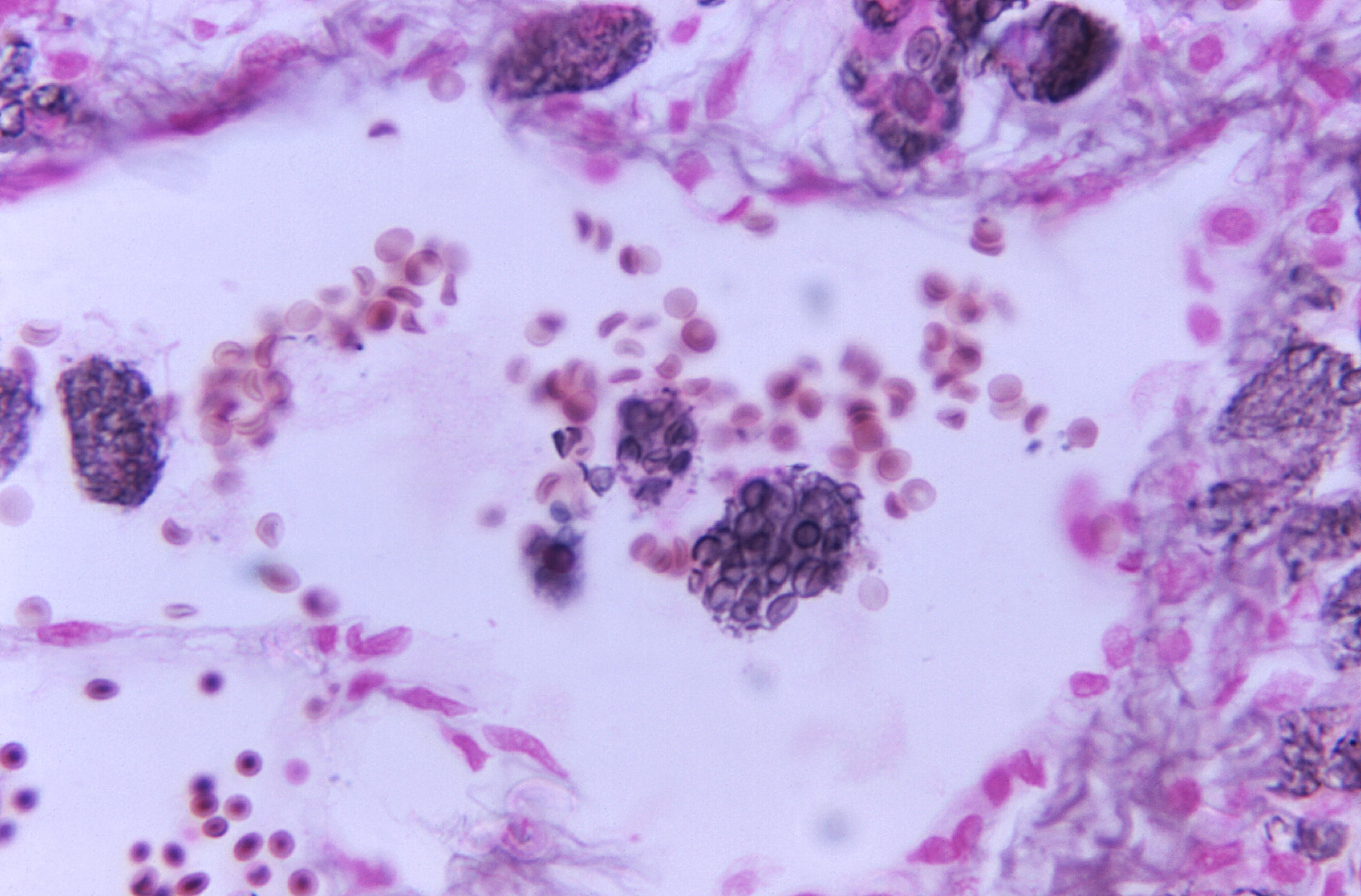
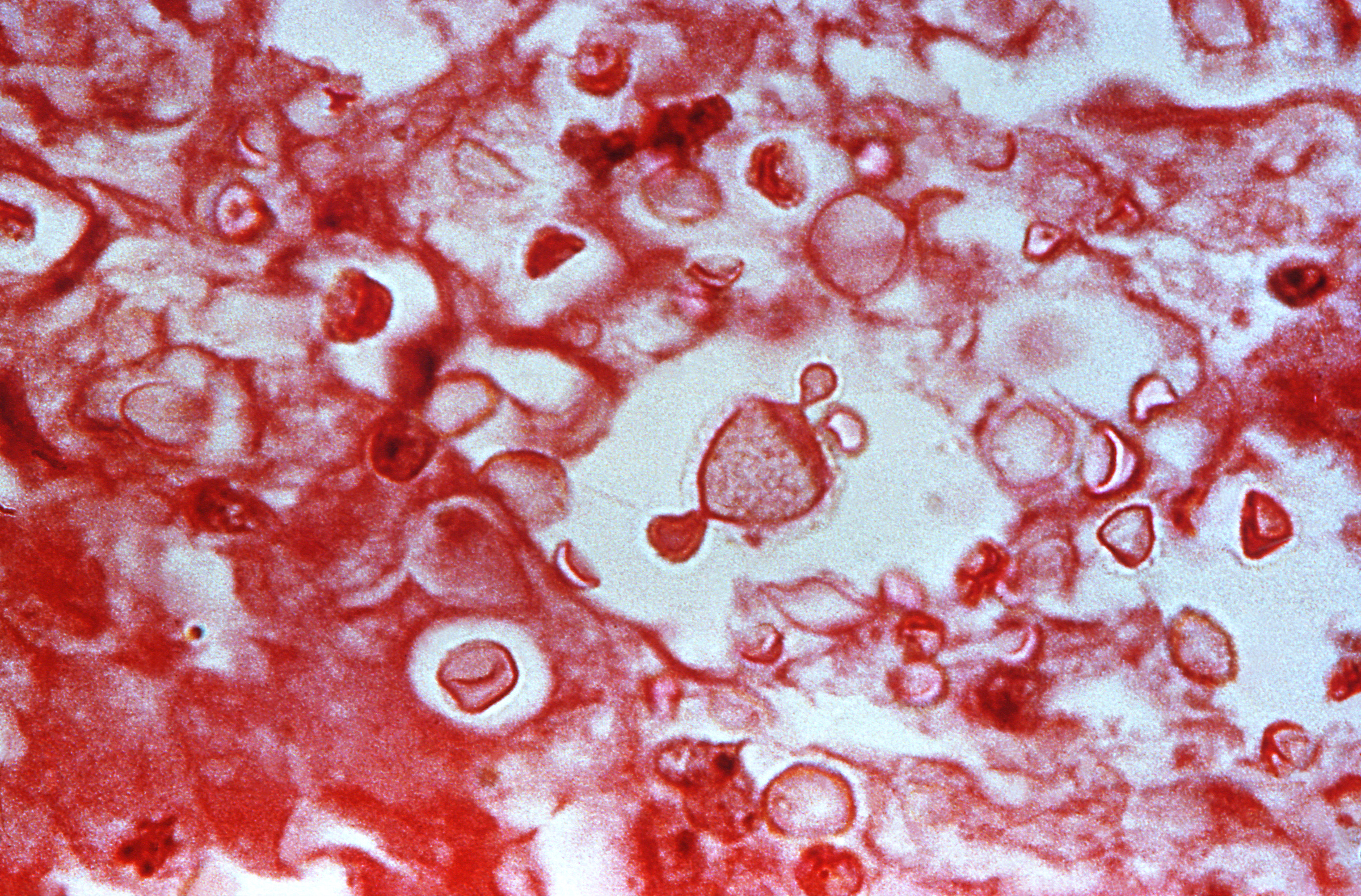
Los cortes histopatológicos pueden
ser coloreados con hematoxilina eosina, plata metenamina de
Grocott-Gomori y ácido peryódico de Schiff (PAS) para observar la
respuesta tisular en los objetivos de 40 X y 100X (no en la PM), sin
embargo, estas coloraciones, a excepción de la PM, tiñen poco las
estructuras del hongo y no evidencia claramente la cápsula, la cual
se sugiere como un espacio vacío alrededor de las blastoconidias.
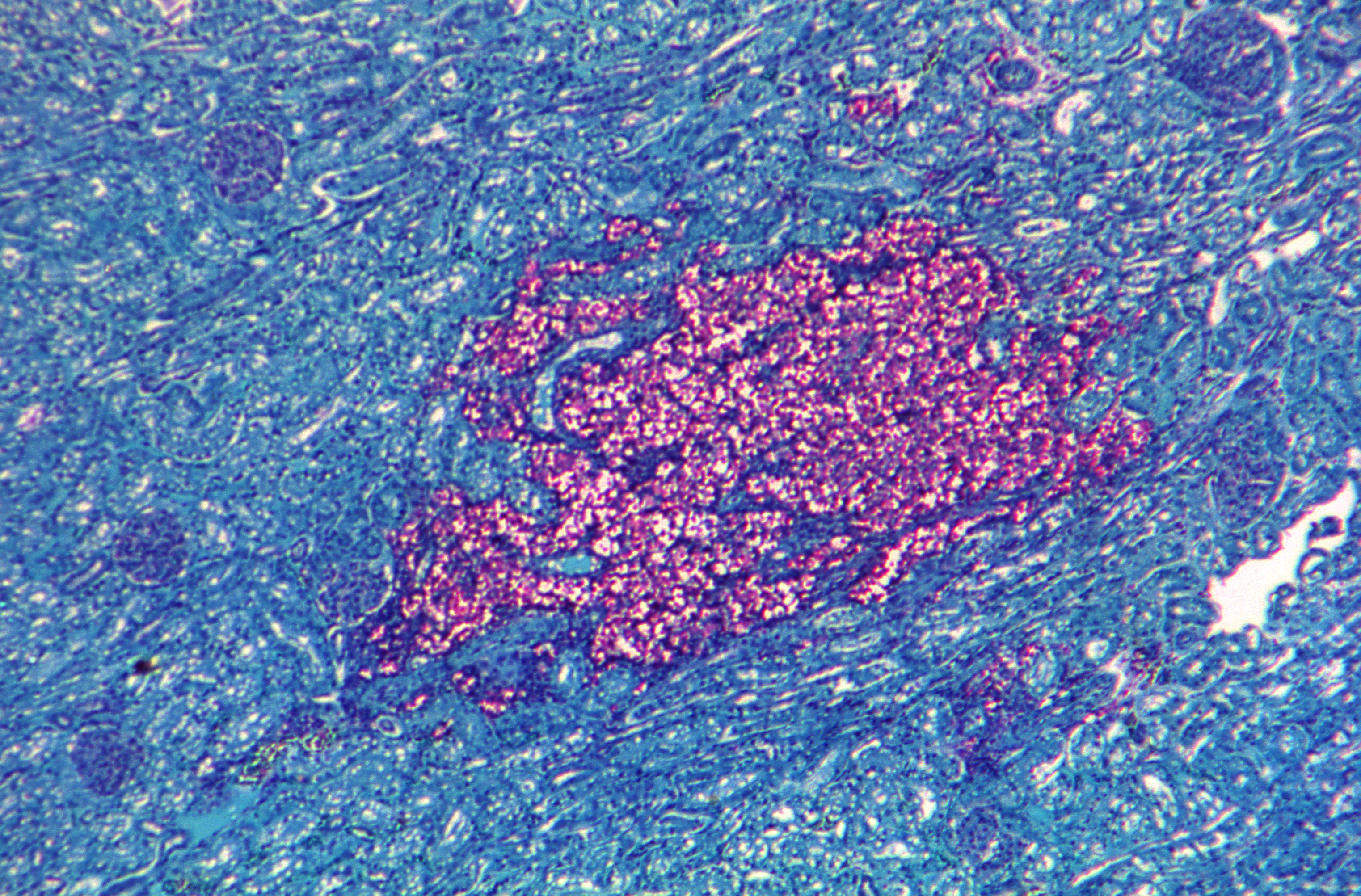
Las coloraciones de Mucicarmina de Meyer y azul de alciano permiten
la tinción de la capsula facilitando la identificación de las
estructuras a nivel de género.
Cultivos
Esta levadura crece muy bien en medios libres de actidiona como el agar Sabouraud y el agar PDA,
también en medios bacteriológicos como el agar sangre, el agar chocolate y el BHI en un periodo de
tiempo de 48 a 72 horas a temperaturas entre 25 a 35 ºC. En estos medios se da la formación de
colonias cremosas o mucoides (aislamientos con abundante cápsula), de color crema o café claro. Para
la recuperación e identificación rápida de Cryptococcus spp. se recomienda el uso de medios
ricos en compuestos fenólicos como agar semilla (girasol, guisotea, alpiste, níger), ácido cafeico,
paprika o rábanos, en los cuales las colonias de este género producen pigmentos café oscuro por la
abundante producción de melanina, lo que facilita su diferenciación de las colonias de
Candida spp. cuyas colonias permanecen blancas o crema. Cuando no se dispone de medio con
compuestos fenólicos, la diferenciación de las colonias de Cryptococcus spp. de otras
levaduras como Candida spp., puede hacerse con un montaje con tinta china para observar la
cápsula o mediante la prueba de la urea a 25 °C en el cuál Cryptococcus spp. al ser ureasa
positiva daría la prueba positiva mientras Candida no viraría el color del medio. Para la
identificación a nivel de complejo de especies se puede utilizar la prueba de la urea incubada a 37
°C, temperatura en la cual las especies del complejo C. neoformans pierde su actividad ureasa
y da la prueba negativa, mientras que los del complejo C. gattii la retiene y da la prueba
positiva. También se puede emplear el medio CGB (canavanina-glicina-azul de bromotimol) en el cual
las especies del complejo gattii al resistir a la acción antifúngica de la canavanina y
crecer utilizando la glicina como fuente de carbono y nitrógeno liberan amoniaco que alcaliniza el
medio de cultivo tornándolo de un color azul, mientras que las especies del complejo
neoformans son incapaces de cambiar el color del medio permaneciendo de color verde. La
identificación más fidedigna a nivel de especie molecular se lograría empleando las técnicas de PCR
de las que se hablará más adelante.
Inmunodiagnóstico
Comercialmente hay disponibles tres métodos para
la detección de antígenos de Cryptococcus, que se pueden
realizar a partir de muestras como líquido cefalorraquídeo, suero,
plasma y sangre total, siendo ampliamente utilizado en el
diagnóstico rápido en pacientes VIH positivos muy inmunosuprimidos.
Las plataformas disponibles son la de aglutinación con partículas de
látex que detecta el antígeno capsular de Cryptococcus spp.
empleando partículas de látex sensibilizadas con anticuerpos contra
el hongo, el inmunoensayo enzimático (EIA) no distribuidos
ampliamente, y el ensayo de flujo lateral (LFA), el cual por su
fácil y rápida realización y bajos costos es la técnica más
utilizada. Estas pruebas pueden ser cuantitativas por lo que pueden
ser empleadas para el seguimiento de los pacientes, no obstante,
recientemente los grupos que han diseñado las guías consenso para el
diagnóstico, tratamiento y vigilancia de los pacientes con
criptococosis descartan el uso de estas pruebas de inmunodiagnóstico
para el seguimiento de la respuesta a la terapia, debido a que no se
observa correlación entre la mejoría de los síntomas y los títulos
de antígeno, por tal razón proponen el cultivo cuantitativo como
único método para hacer este seguimiento.
Pruebas moleculares
Las técnicas de biología molecular pueden ser empleadas para la
búsqueda directa del material genético del hongo en las muestras de
los pacientes o para obtener la identificación a nivel de especie
una vez el hongo sea recuperado del cultivo. En el mercado se cuenta
con el panel de PCR BioFire FilmArray Meningitis/Encephalitis
(Biofire Diagnostics, Salt Lake City, UT) aprobado por el FDA en el
2016 que consiste en una PCR múltiple para 14 blancos los cuales
incluyen bacterias, virus y levaduras del complejo C. neoformans y
C. gattii.
Para la identificación de especies a partir de los
aislamientos se han empleado diversas técnicas moleculares.
Inicialmente se utilizaron los métodos de hibridación ADN-ADN y
electrocariotipificación. Más recientemente se han aplicado técnicas
de identificación basadas en PCR (anidada, multiplex, en tiempo
real) y de tipificación como PCR fingerprinting, RAPD, PCR–RFLP,
AFLP y MLST.
Galeria Criptococosis